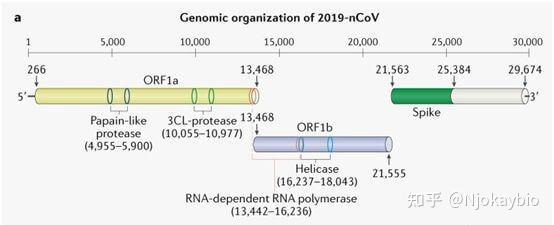
[新型冠状病毒BA]新型冠状病毒(2019-nCoV)结构及感染途径
2019新式流感病原体(2019-nCoV)是一类捷伊流感病原体,与SARS-CoV同归属于网巢病原体目流感病原体科的β-CoV,为一类不前段段的dsRNA正链RNA病原体,其两组DNA组宽度约30000个碱基以内。与中东地区吞咽综合症流感病原体(MERS-CoV)和轻微慢性吞咽综合症流感病原体(SARS-CoV)不同,2019-nCoV是病毒感染人类文明的流感病原体家族企业中的第7个。从DNA序列p53上而言,2019-nCoVDNA组与SARS具有80%的关联性,2019-nCoV与MERS-CoV的DNA序列有40%的关联性。
2019新式流感病原体(2019-nCoV)整体表现出众所周知的流感病原体属内部结构:5个未译者区(UTR)、 拷贝酶复合物(orf1ab)、SDNA、EDNA、MDNA、NDNA、3个UTR,以及两个未辨识的非内部结构对外开放写作框。



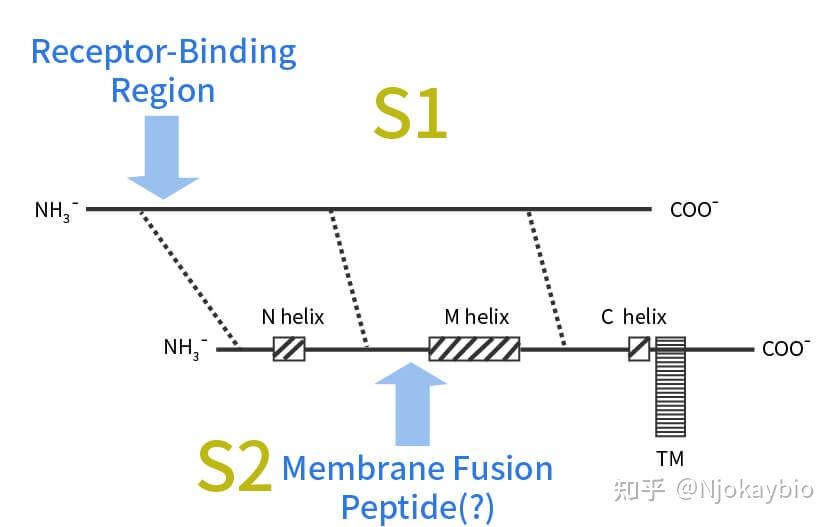
S蛋白质是流感病原体表层最重要的糖蛋白质。它有四个核糖体共同组成。紧邻N端部份逐步形成四个椭圆形核糖体,紧邻C端部份逐步形成四个穿膜的棒状内部结构。科学研究说明,S蛋白质和流感病原体入侵细胞核的操作过程息息相关。S蛋白质类似物在寄主的细胞核核中制备以后会被切开四个部份,S1和S2。

S蛋白质类似物四个研磨乙醛的交互作用亲密关系
其中S1逐步形成成形蛋白质的棒状部份,S2逐步形成成形蛋白质的棒状部份,包括四个N helix,四个M helix,四个C helix和四个穿膜部份。S1和S2之间通过大分子间交互作用力紧密结合。S2的穿膜部份把整座S蛋白质一般而言在病原体机壳膜上。
美国得克萨斯理工学院奥斯丁附属小学科学研究项目组对新冠病原体的新一代科学研究结果说明,新冠S蛋白质约由1300个胺基酸共同组成,其被拆成的S1核糖体约700个胺基酸,S2核糖体约600个胺基酸,四个S1/S2异底物装配逐步形成四个四聚体离峰,从病原体内皮细胞核注重。其中,300多个胺基酸构成的受体紧密结合区RBD是负责与寄主细胞核受体紧密结合的关键。
N蛋白质是流感病原体中另一类重要的内部结构蛋白质。在流感病原体颗粒中,N蛋白质处于病原体颗粒的核心部份,以和Genomic RNA紧密结合的形式存在。以前对鼠肝炎病原体的科学研究说明,N蛋白质对于病原体DNA组RNA特征序列的辨识及其与其它内部结构蛋白质的交互作用,对于病原体粒子的准确装配有着重要意义。
M蛋白质是一类跨糖蛋白质,它与S蛋白质的紧密结合,被认为是流感病原体颗粒装配操作过程中的又一关键信号。
利用NCBI上的ORFfinder工具进行该病原体的DNA组注释分析。
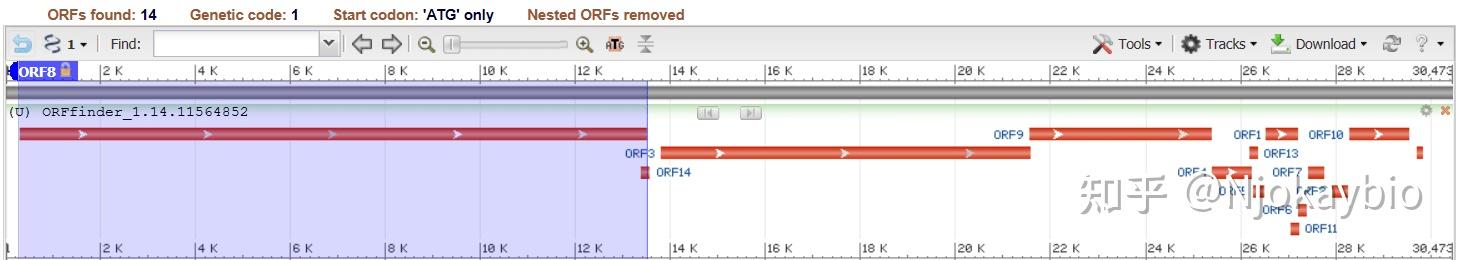

软件给出了14个主要的对外开放写作框。下图中标明了orf1ab和四个主要内部结构蛋白质的位置。

系统进化树的构建


通过下载一系列相关的SARS-CoV、bat-SARS-CoV以及一些蝙蝠来源的α、β流感病原体全DNA组序列,通过MEGAX软件进行多重序列比对并构建了系统进化树。可以看到新冠病原体跟bat-SL-CoVZC45归属于同一分支,但距离人源的SARS-CoV病原体较远。
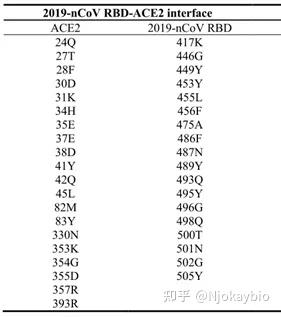
2019-nCoVDNA组编码非内部结构蛋白质(比如3-胰凝乳蛋白质酶样蛋白质酶、木瓜蛋白质酶样蛋白质酶、解旋酶、RNA依赖性RNA聚合酶)、内部结构蛋白质(比如刺突糖蛋白质)和辅助蛋白质。上面提到的这四种非内部结构蛋白质是病原体生命周期中的关键酶,而刺突糖蛋白质(spike protein)对于病原体进入细胞核操作过程中的病原体-细胞核受体交互作用是必不可少的。棘突蛋白质包含2个亚单位:S1和S2。S1能够促进病原体与寄主细胞核受体的紧密结合,其含有四个重要的C端RBD核糖体,正是这个区域负责和受体紧密结合。新式流感病原体RBD核糖体的有一些DNA区域与SARS有高度的p53。其中SARS病毒感染的5个关键位点中,有1个被新式流感病原体保留,其余4个有胺基酸的替换和变化。2019-nCoV由于RBD核糖体胺基酸变化,丢失了一些氢键作用,使得自由能上升,说明新式病原体紧密结合能力要弱于SARS-CoV。 有科学研究说明,2019-nCoV 与轻微慢性吞咽综合症流感病原体 (SARS-CoV) 息息相关,被认为与 SARS 具有相同的受体即血管紧张素转换酶 2 (ACE2),ACE2 在介导 2019-nCoV 病毒感染中的作用已经得到证实。
与SARS相似,新式流感病原体是通过S-蛋白质与人ACE2互作的大分子机制,来病毒感染人的吞咽道上皮细胞核。2019-nCoV能够辨识血管紧张转化酶2(ACE2),通过棘突蛋白质与ACE2紧密结合再通过胞吞作用入侵细胞核。ACE2为糖蛋白质,在肺部细胞核多有分布,病原体与ACE2紧密结合后进入肺细胞核,导致肺炎。S蛋白质介导流感病原体的入侵操作过程主要分为四个部份:
1、S蛋白质辨识并紧密结合寄主细胞核受体
新流感病原体通过S蛋白质上受体紧密结合域RBD与寄主细胞核的受体ACE2紧密结合,这是病原体病毒感染的起始步骤。最近,发表在BioRxiv的文章Crystal structure of the 2019-nCoV spike receptor-binding domain bound with the ACE2 receptor中,作者利用X射线衍射技术,解析了2019-nCoV表层刺突糖蛋白质受体紧密结合区与人受体ACE2蛋白质复合物的晶体内部结构,内部结构分析确定了2019-nCoV中对ACE2紧密结合至关重要的残基,其中大多数是高度保守的或与SARS-CoV RBD中的残基具有相似的侧链特性。这种内部结构和序列上的关联性强烈支持2019-nCoV和SARS-CoV RBD之间会发生融合进化,从而改善与ACE2的紧密结合,尽管它们被隔离在β流感病原体属的不同遗传谱系中。
2、病原体与寄主细胞核融合
当2019-nCoV RBD与细胞核表层受体ACE2特异紧密结合后,S2蛋白质会发生构象变化,在寄主蛋白质酶的研磨下被激活,S蛋白质构象发生改变,膜融合肽释放,插入到寄主细胞核膜上,随后S2核糖体上的四个七肽重复序列逐步形成六螺旋束,拉近病原体内皮细胞核与寄主细胞核膜之间的距离,进而促使病原体与寄主细胞核融合,介导病原体的进入。
有科学研究说明,2019-nCoV与ACE2的亲和力是SARS与ACE2亲和力的10~20倍。当2019-nCoV Spike蛋白质与ACE蛋白质紧密结合后,紧密结合的5个胺基酸有4个发生了变化,但是整体上蛋白质的构象并没有改变,因此2019-nCoV与ACE2具有很高的亲和力。
推荐阅读
-

?宝马新5系配置详解!这17款车型你最想入手哪一个?
-
黑龙江省290农场一天比一天热这钱真不好挣是用汗水换来的哎
{{if!data.isVip&&data.isActText}}{{elseif!data.isVip...
-
黑龙江干流堤防290农场段再次出现溃口
本报记者从吉林省水利厅水利厅司令部了解到,继16日再次出现宁远河后,27日7时,吉林河段堤防290农庄段悲剧重演宁远河。历经三个多...
-
黑龙江农险冰火两重天地方财力不足致补贴不一|农业保险|农险|财力
位于中俄林密吉林沿线的集贤县五原镇东方村今年遭遇洪水侵袭,许多农农作物受灾地区,农民周俊民种的200亩小麦几乎无人问津。幸好他参与...
-
黑龙江农垦290农场大雁繁育基地成为湿地生态养殖亮点
【编者按·中国军用养殖业网】日前,农牧一八〇农庄红树林自然保护区不远处,1500万头毛发亮光、身形丰满的雁在大坑里无拘无束地玩耍,...
-
鲜为人知的“料罗湾海战”——晚明与荷兰的战争
事件起因国内背景明崇祯时期,受小冰河期影响。中国北方长年干旱、中原和东部数次特大地震、北方瘟疫流行。除江浙闽粤一带受灾影响后仍然恢...
-
魏县关于进一步调整疫情封控管控措施的通告
肥乡县禽流感防控工作工作组办公室关于更进一步修正禽流感封控管控举措的通告各阶层农村居民:为统筹推进禽流感防控工作和经济社会发展,...
-

高职高考2022年可报考院校及最低录取分数线
-

高尿酸常常没有症状尿酸高可致痛风肾病和结石
-
高一学生举报老师教师节强制收礼:教师节,你准备送礼吗
立刻就要到此日了,每月那个时期,小学生家长们都心里感到恐惧,特别是新升学的小孩小学生家长,不晓得要千万别给同学赠礼,也不晓得新幼儿...

